Venózní trombembolismus v těhotenství
II. interní klinika kardiologie a angiologie, 1. LF UK a VFN, Praha
Souhrn
Hluboká žilní trombóza a plicní embolie jsou obávanými stavy během těhotenství a porodu, ale jejich riziko u disponovaných je vysoké i postpartálně. Riziko vzniku žilní trombembolie by mělo být vyhodnoceno optimálně již před početím. Profylaxe u rizikových žen se opírá o aplikaci nízkomolekulárního heparinu, který je i základním léčebným přípravkem při eventuálním vzniku akutní příhody. Při podezření na přítomnost žilní trombózy nebo plicní embolizace nejsou D‑dimery spolehlivým vodítkem, proto je nutno provést zobrazení žilního systému a plicní cirkulace (duplexní ultrasonografií, CT nebo MR angiografií, plicní scintigrafií). (Kap Kardiol 2019; 11: 52–57)
Klíčová slova
· žilní trombóza · plicní embolie · trombembolická nemoc · těhotenství
Úvod
Žilní trombóza a plicní embolie (trombembolická nemoc – TEN) jsou během těhotenství a šestinedělí naštěstí poměrně vzácnými stavy, nicméně jsou důležitými příčinami morbidity i mortality u žen v reprodukčním věku (postihují 0,05–0,2 % těhotných). Těhotenství i při celkově nízkém absolutním riziku zvyšuje riziko vzniku trombózy minimálně čtyř‑ až pětinásobně, přičemž pouze ve 20 % jde o trombózu v arteriálním řečišti, ve většině případů jde o trombózu žilní. Fatální plicní embolie je pátou nejčastější příčinou úmrtí žen v souvislosti s těhotenstvím. Největší riziko vzniku žilní trombózy (a případně komplikující plicní embolie) je v posledním trimestru těhotenství a zejména postpartálně. Tedy zatímco v rozvojových zemích je hlavní příčinou úmrtí rodiček krvácení, ve vyspělých jde o trombembolické příhody.
Patofyziologie vzniku žilní trombózy během těhotenství
Hlavním stimulem vzniku trombu je hyperkoagulační stav daný hormonálně, který chrání plod před nežádoucím krvácením, resp. potratem, brání většímu krvácení během porodu. Je snížena antikoagulační aktivita proteinu S, stoupá rezistence k aktivovanému proteinu C, zvyšuje se koagulační aktivita v důsledku vyšší hladiny fibrinogenu, faktoru V, VIII, IX a X, navíc je snížena fibrinolytická kapacita kvůli změně koncentrace inhibitoru aktivátoru plasminogenu – PAI‑1 i PAI‑2 (tab. 1).
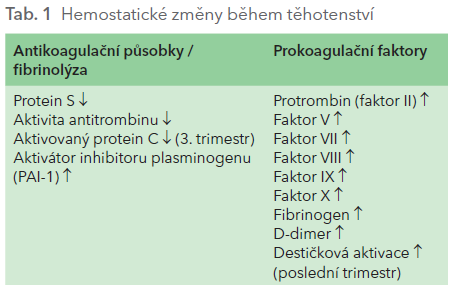
Dále se zde uplatňují i další komponenty Virchowovy trias: zpomalení žilního toku (venodilatace indukovaná progesteronem, žilní komprese daná tlakem zvětšující se dělohy na ilické vény, zejména levostranně, posléze i menší mobilita těhotných ve vyšším stupni těhotenství), může se uplatnit i poškození endotelu (například postpartálně nebo po porodu sekcí). Řada dalších faktorů, jak vrozených, tak získaných, pak umocňuje riziko trombotické příhody (tab. 2).
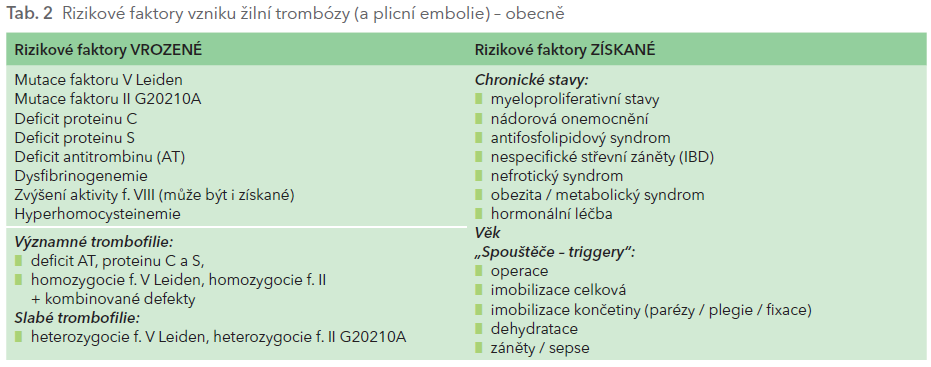
Pokud bychom zvažovali „laboratorní“ trombofilní stavy, pak míra rizika závisí na typu trombofilního stavu – deficity antikoagulačně působících proteinů jsou významnější než v populaci častější heterozygotní mutace faktorů V nebo II. Velmi důležitá je zde i osobní a zejména pak rodinná anamnéza žilní trombózy nebo plicní embolie.
U těhotných s trombofilií je celkově vyšší riziko těhotenských komplikací, mezi něž patří nejen častější žilní trombembolické příhody, ale i časné a pozdní potraty, růstová retardace plodu, placentární abrupce a preeklampsie.
Klasifikace výše rizika žilní trombózy u těhotných
Na základě přítomnosti rizikových faktorů by každá žena měla být již v začátku těhotenství (pokud ne dokonce před plánovaným početím) klasifikována na základě přítomnosti rizikových faktorů vzniku trombózy na vysoce rizikovou, středně rizikovou nebo těhotnou s nízkým rizikem vzniku trombózy.
Za nejvyšší riziko vzniku žilní trombózy je nutno považovat stav předchozích rekurentních, neprovokovaných žilních trombóz (což je naštěstí v daném věku vzácné), ale běžnější a obdobně vysoce rizikovým stavem pro rekurenci je pozitivní anamnéza trombózy vzniklé v souvislosti s předchozím těhotenstvím nebo léčbou estrogeny.
Vysoce rizikovým stavem pro žilní trombózu je také ovariální hyperstimulační syndrom, proto musí být těhotná při jeho vzniku profylakticky zajištěna nízkomolekulárními hepariny během prvého trimestru.
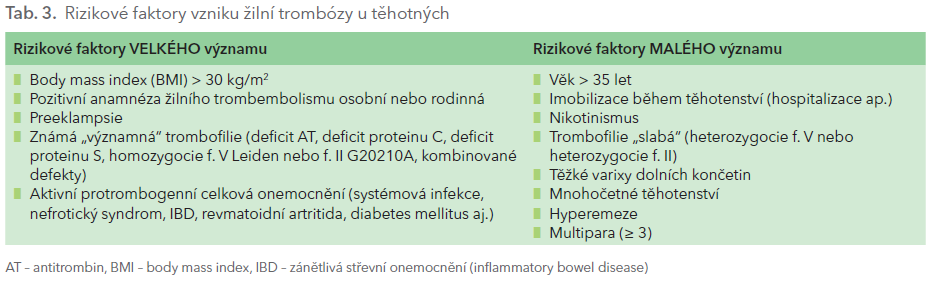
Počáteční klasifikace se dále může měnit dle průběhu těhotenství (a typu porodu) a dle případných nově vzniklých komorbidit, zejména v situaci, kdy těhotná je pro ně přijata k hospitalizaci (tab. 3 a tab. 4).

Prevence žilní trombembolie u rizikových těhotných a postpartálně
Prevence u vytipovaných těhotných se na základě vyhodnocení jejich rizika vzniku žilní trombózy podává prenatálně (prakticky u většiny pak během celého těhotenství), ale také postpartálně.
Základem medikamentózní prevence (i léčby) žilní trombózy a plicní embolie v těhotenství jsou nízkomolekulární hepariny (LMWH). Jejich hlavní výhodou při dlouhodobém podávání je nižší riziko vzniku osteoporózy (ve srovnání s klasickým, nefrakcionovaným heparinem). Iniciální preventivní dávka se určuje dle hmotnosti v prvním trimestru, při velkých změnách váhy následně je nutno upravit dávku a kontrolovat hladinu anti‑Xa, zejména u morbidně obézních. U těhotných ve vyšším riziku TEN by měla dávka LMWH činit alespoň 0,5 IU/kg jedenkrát denně (tab. 5).
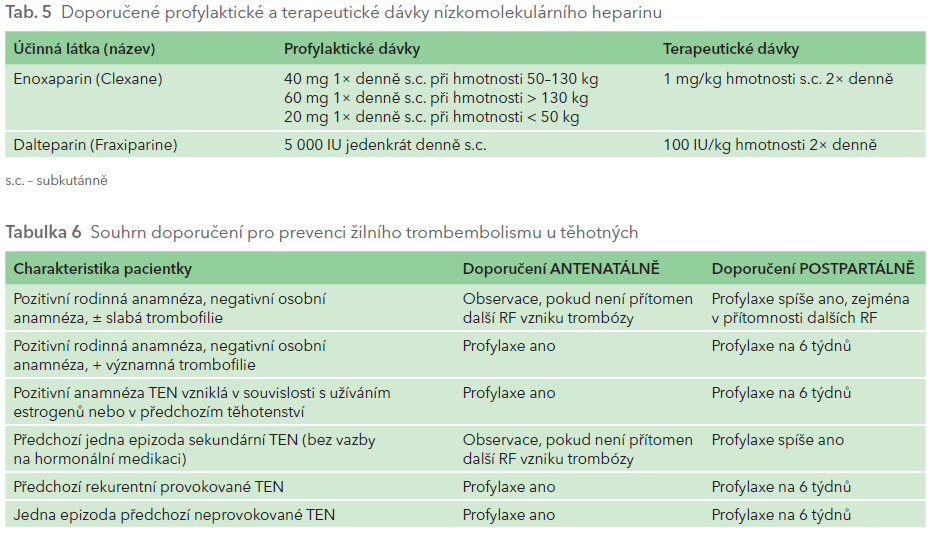
Součástí tromboprofylaxe v těhotenství (i postpartálně) jsou také nefarmakologické postupy:
- nošení kompresivních punčoch během dne (zejména u nemocných s výraznými varixy dolních končetin),
- ponechání maximální mobility, i během případné nutné hospitalizace,
- dostatečná hydratace,
- případné mechanické, přístrojové metody posilování žilního toku (zejména při kontraindikaci podání LMWH).
Tromboprofylaxe postpartální je mírně opomíjenou kapitolou. Může být realizována opět podáním nízkomolekulárního heparinu, případně warfarinu, a to i u kojících (warfarin nepřestupuje do mléka). Aplikace LMWH se zahajuje 6–12 hodin po vaginálním porodu i porodu sekcí, pokud není přítomno vysoké riziko krvácení. Častěji se podává první dávka den po porodu. Pokud je tromboprofylaxe indikována pro trvající rizika i po dobu šestinedělí, pak možno převést na warfarin.
Nová perorální antikoagulancia (gatran, xabany) nejsou schválena pro těhotné ani pro kojící.
Všechny rodičky po sekci mají mít profylaxi trombózy minimálně kompresí končetin po dobu alespoň pěti dnů nebo do propuštění, nejsou‑li jinak rizikové pro TEN. Pro středně až vysoce rizikové ženy, které rodily sekcí a u nichž farmakoprofylaxe nemůže být podána, například pro vysoké riziko krvácení, je nutné zavést intermitentní přístrojovou kompresní léčbu.
Důležité ale je, jak dlouho vést profylaxi: pokud riziko přetrvává, pak léčba nemůže být ukončena propuštěním z nemocnice, ale měla by trvat po celé šestinedělí.
Souhrnem lze říci, že základními indiciemi pro zahájení farmakologické tromboprofylaxe v těhotenství je pozitivní rodinná anamnéza žilní trombózy a plicní embolie, zejména při průkazu významné trombofilie, dále pak předchozí trombóza provokovaná hormony v osobní anamnéze, nebo předchozí idiopatická trombóza (tab. 6). Naopak málo významná trombofilie (heterozygocie f. V nebo f. II) nejsou samy o sobě imperativem k tromboprofylaxi, pokud však nejsou přítomna další rizika.
Diagnostika a léčba žilního trombembolismu v těhotenství
Akutní žilní trombóza
Základními příznaky žilní trombózy je i u těhotných bolest a otok končetiny, přičemž rozsah otoku závisí na výši žilního uzávěru. V těhotenství se častěji vyvíjí ilická trombóza, kdy ve více než 80 % jde o levostrannou lokalizaci – pro možnost uplatnění tzv. Mayova‑Thurnerova syndromu (který je dán křížením levé ilické vény s pravostrannou ilickou tepnou, s možností útlaku vény) a současný tlak dělohy. U této lokalizace je specifické, že otoku často předchází bolest v oblasti dolní části zad, hýždě, třísla nebo břicha, což neupomíná na možnost trombózy. Tato se pak šíří distálně a teprve druhotně vzniká otok končetiny.
Základem diagnostiky žilní trombózy v těhotenství je duplexní ultrasonografie (DUS), která má vysokou senzitivitu i specificitu, zejména pro popliteo‑femorální povodí, menší pak v oblasti distálních (bércových) žil a při izolovaném pánevním postižení. Velmi častým nálezem u těhotných bývá tzv. spontánní echokontrast, který lze považovat za „protrombogenní stav“, jenž závisí na více faktorech: na hydrataci těhotné, na míře distenze jejích žil – a nemůže být považován za průkaz trombózy.
V některých situacích, je‑li iniciální kompresní sonografie negativní a suspekce vysoká, pak je namístě těhotnou pozvat ke kontrolnímu vyšetření za tři nebo i za sedm dní a současně sledovat vývoj hladin D‑dimerů. Ale samotná vyšší hladina není jednoznačnou indicií průkazu flebotrombózy, protože u všech těhotných je hodnota D‑dimerů zpravidla zvýšena (jejich hladina se postupně v každém trimestru zvyšuje).
Léčba se opírá o podávání nízkomolekulárního heparinu dle hmotnosti, optimálně dvakrát denně subkutánně.
Trombolytická léčba, i lokálně aplikovaná (tedy v menší dávce než u systémového podání), je u těhotných kontraindikována. Upřednostňujeme bezpečnost léčby před snahou o maximální rekanalizaci žíly. Během těhotenství i kojení jsou rovněž kontraindikována přímá perorální antikoagulancia (gatrany, xabany), a to v léčbě žilní trombózy i plicní embolie. Ani pro fondaparinux nemáme dostatek dat o bezpečnosti, takže jeho užití je rezervováno pro stavy heparinem‑indukované trombocytopenie (7,5 mg jedenkrát denně léčebně; 2,5 mg jedenkrát denně profylakticky).
Pozn.: Rozsáhlé varikoflebitidy postihující úsek žíly delší než 5 cm nebo lokalizované v blízkosti přestupu do hlubokého žilního systému léčíme taktéž nízkomolekulárním heparinem ve středních dávkách, a sice po dobu 2–6 týdnů do ústupu příznaků (současně komprimujeme končetinu a můžeme lokálně aplikovat nesteroidní antirevmatikum nebo heparinoid).
Plicní embolie
Symptomy a známky plicní embolie jsou stejné jako u netěhotných: charakteristická je dyspnoe (nemusí se vždy jednat o dušnost klidovou), dále bolest na hrudi, tachykardie, případně kašel, hemoptýza, vzácně synkopa jako iniciální příznak. Zavádějící mohou být příznaky námahové dušnosti a tachykardie, protože oba tyto symptomy jsou u těhotných často vyjádřeny.
Diagnostika plicní embolie u těhotných je stále předmětem diskusí. Jde o to, zda lze užít modifikované Wellsovo (nebo ženevské) skóre k určení malé pravděpodobnosti přítomnosti plicní embolie a zabránění nežádoucí expozici záření. Spíše ale se u těhotných skórovací systémy ani využití posouzení hladiny D‑dimerů nedoporučují.
Při podezření na plicní embolizaci se postupuje přímo pomocí zobrazovacích metod, přičemž se začíná bilaterální duplexní ultrasonografií končetin a echokardiografickým vyšetřením (k posouzení funkce pravé komory). I při negativních nálezech těchto dvou vyšetření je namístě provedení skiagramu hrudníku, a je‑li tento normální, pak perfuzní scintigrafie plic. V případě abnormality nálezu RTG hrudníku se provádí CT angiografie plicnice, případně MR angiografie.
Lékem volby v těhotenství a šestinedělí je nízkomolekulární heparin v terapeutické dávce: podáváme enoxaparin 1 mg/kg tělesné hmotnosti nebo dalteparin 100 IU/kg hmotnosti, v režimu dvakrát denně, s cílovou hodnotou anti‑Xa 0,6–1,2 IU/ml.
Nefrakcionovaný heparin je dosud lékem volby u tzv. masivní („high‑risk“) plicní embolie, charakteristické klinicky především hypotenzí a tachykardií, s hrozícím vývinem kardiogenního šoku, při jehož vzniku je pro záchranu života těhotné nutné podání systémové dávky trombolytika. Celkově však v těhotenství i časně postpartálně se trombolytické léčbě pro extrémně vysoké riziko krvácivých komplikací snažíme vyhnout.
Indikace zavedení kaválního filtru jsou obdobné jako u netěhotných: jde o nemožnost antikoagulační léčby z důvodu vysokého rizika krvácení, dále o recidivu příhody i při adekvátní antikoagulační medikaci, nemožnost pokračovat v antikoagulační léčbě pro vzniklé krvácení. Je namístě preferovat dočasné kavální filtry, protože jde o mladé pacientky s dočasně působícím rizikem vzniku trombembolismu.
Antikoagulační medikace před porodem, během porodu a po něm
U plánovaných porodů je žádoucí vysazení LMWH 24 hodin před termínem, obvykle v 39. týdnu. Vysazení antikoagulační medikace na 24 nebo dokonce 36 hodin může být problematické u žen, u nichž je vysoké riziko recidivy žilní trombembolie, nebo u těch, kde akutní příhoda vznikla v posledním měsíci těhotenství. U těchto žen je bezpečnější převedení na nefrakcionovaný heparin – minimálně 36 hodin před porodem a ukončení jeho aplikace 4–6 hodin před porodem. Opětně zahajujeme antikoagulační léčbu šest hodin po vaginálním porodu a 12 hodin po sekci, pokud není abnormální krvácení.
Celková délka antikoagulační terapie po zvládnutí akutního stavu u plicní embolie, ale i žilní trombózy je vždy několikaměsíční: od akutní příhody v těhotenství po celou dobu šestinedělí, celkově minimálně po tři měsíce (u distálních trombóz a tzv. low‑risk plicních embolií), obvykle léčbu vedeme po dobu šesti měsíců. Pokud jsou rizikové faktory vzniku trombembolie, kromě hormonální příčiny, identifikovány a trvají, pak podle velikosti trombózy / plicní embolie a míry rizikovosti stavu se rozhodujeme k prolongované, event. i „neohraničené“ délce antikoagulační medikace (například při významné trombofilii nebo po druhé a vícečetné recidivě stavu).
Kasuistika – život ohrožující plicní embolie peripartálně
Jednačtyřicetiletá nemocná astenického habitu, s anamnézou polytraumatu v mládí (v roce 1990), kdy zřejmě v souvislosti se zavedenou centrální žilní kanylou měla zjištěnu trombózu jugulární vény. Již tehdy byla prokázána mutace faktoru V Leiden a mutace faktoru II, obě v heterozygotní konstituci, dále homozygotní mutace MTHFR 677 (tato ale samostatně není považována za významný trombofilní stav!). Následně v letech 1998–2002 porodila nekomplikovaně tři děti.
V letošním roce během čtvrtého mnohočetného těhotenství došlo k rozvoji gestačního diabetu, který je také považován za prokoagulační faktor. Během celého těhotenství byl podáván LMWH (enoxaparin 0,6 ml s.c. jedenkrát denně), poslední aplikace byla 24 hodin před plánovaným císařským řezem (příčná poloha, dvojčata). V průběhu operace (sectio caesarea, oboustranná salpingektomie) došlo k epizodě oběhové nestability s hypokapnií, hypoxií, hypotenzí, přechodně se vyskytla i blokáda pravého Tawarova raménka. Na děloze a v oblasti ligament byly shledány četné varixy. Pacientka byla následně převezena na CT angiografii, kde byl potvrzen nález masivní plicní embolie v bifurkaci truncus pulmonalis a bilaterální postižení hlavních větví (obr. 1).
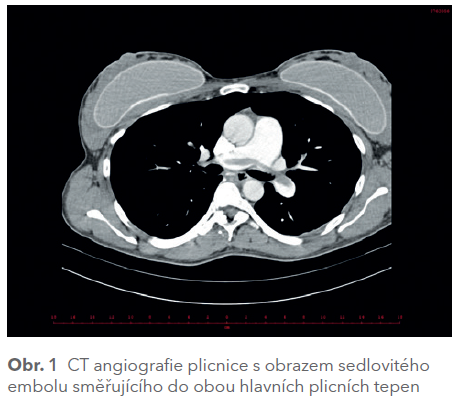
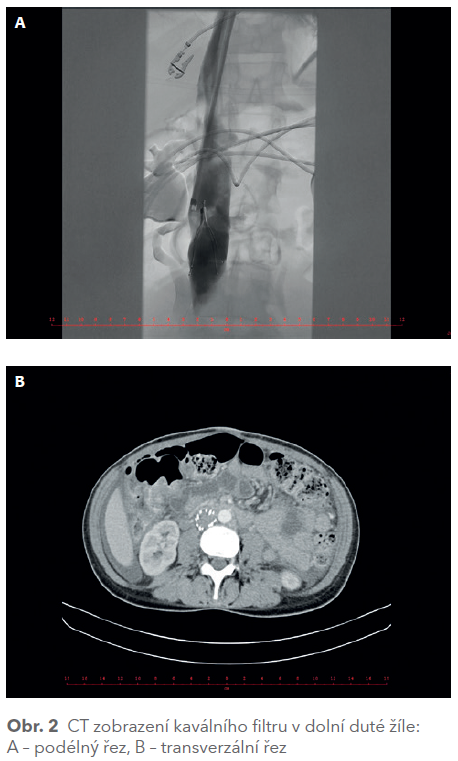
Pacientka byla proto dále hospitalizována na oddělení resuscitace a intenzivní medicíny. Byla antikoagulována nefrakcionovaným heparinem a byl jí implantován kavální filtr (obr. 2).
Echokardiograficky („bedside“) byla pravá komora nezvětšená, s dobrou systolickou funkcí, pravá síň byla hraniční velikosti, nebyla přítomna trikuspidální regurgitace. V laboratorních výsledcích přítomna anémie (Hb 82 g/l), extrémně zvýšena hodnota D‑dimeru (> 6 400 µg/l). Následně podáván LMWH (enoxaparin 0,6 ml, resp. 0,8 ml 2× denně), s kontrolami anti‑Xa, které se stále pohybovaly při dolní hranici doporučeného terapeutického rozmezí.
Nemocnou jsme vyšetřili cévně po propuštění z porodnice, 11. den po sekci a masivní plicní embolii, kdy byla plně mobilní, hemodynamicky kompenzovaná, anemická, schopna péče o dvojčata. Doplněná duplexní ultrasonografie neukázala trombózu ani její rezidua v žilách dolních končetin. Pacientka byla nadále antikoagulována nízkomolekulárním heparinem, s plánovaným přechodem na warfarin.
Závěr kasuistiky: nemocná se známou kombinovanou hereditární trombofilií byla během těhotenství adekvátně zajištěna nízkomolekulárním heparinem, dokonce ve vyšší profylaktické dávce. Před plánovaným výkonem byl LMWH vysazen v obvyklém odstupu 24 hodin. Peroperačně došlo k hemodynamické nestabilitě jako projevu „masivní“ oboustranné plicní embolie, následně potvrzené CT, nicméně tromby obtékány, segmentární i subsegmentární větve se plnily. Nemocná dobře léčebně zareagovala na podaný nefrakcionovaný heparin, přechodně byla nutná neinvazivní plicní ventilace a implantován dočasný kavální filtr k prevenci eventuální následné embolie. Zdroj plicní embolizace nebyl ani dodatečně v žilách končetin zjištěn, pravděpodobným zdrojem byly pánevní varixy. Nemocná je indikována k dlouhodobé antikoagulační léčbě (na „neurčitou“ dobu). V době kojení nutno podávat warfarin. Úvaha o prolongované antikoagulační léčbě je dána jednak dvěma trombotickými událostmi v anamnéze (jedna z nich potenciálně život ohrožující) a přítomností kombinované trombofilie. V plánu je zvážení explantace kaválního filtru, bude‑li antikoagulační léčba nekomplikovaná.
Závěr
Prevence žilní trombembolie u rizikových těhotných je klíčová. Samotný, méně významný trombofilní stav, jako např. leidenská heterozygotní mutace faktoru V nebo mutace faktoru II, bez dalších rizik, není ale důvodem k rutinnímu podávání nízkomolekulárního heparinu. Nutno zvažovat veškeré další rizikové faktory, i preexistující, dále faktory vázané na těhotenství a jeho průběh a další dočasně působící (např. ovariální hyperstimulační syndrom s vysokým rizikem trombózy v prvním trimestru). Důležité je uvědomit si, že zvýšené riziko není jen v těhotenství, ale stoupá dále při porodu, zejména v případě chirurgického přístupu, případně následně po výkonu (infekce, větší ztráty krve ap.).
U těhotných je častěji přítomna trombóza v oblasti ilických vén, zejména vlevo, která se může projevit atypickou bolestí v zádech a hýždi, kdy zpočátku může chybět i otok končetiny. Diagnostika žilní trombózy se opírá o nonkompresibilitu zobrazených vén a další známky poruchy žilní drenáže. U nemocných s nekonkluzivním sonografickým nálezem nutno přistoupit buď k časnému zopakování tohoto vyšetření, nebo zobrazit vény pomocí magnetické rezonance. Diagnostika plicní embolie se opírá v začátku opět o duplexní ultrasonografii obou končetin, o echokardiografické posouzení pravostranných srdečních oddílů a tenze v plicnici, následně pak zejména o perfuzní scintigrafii, častěji však dnes o CT angiografii. Léčebně podáváme nízkomolekulární heparin dle hmotnosti, lépe ve dvou denních dávkách, s event. monitorací účinnosti léčby pomocí stanovení koncentrace anti‑Xa. Trombolytická léčba je indikována pouze v situaci, kdy jde o záchranu života matky při nedostatečném účinku antikoagulační léčby heparinem. Nová přímá perorální antikoagulancia (xabany a dabigatran) nejsou dosud schválena pro léčbu v těhotenství a během kojení.
Literatura
1. Regitz‑Zagrosek V, Roos‑Hesselink JW, Bauersachs J, et al., ESC Scientific Document Group. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J 2018;39:3165–3241.
2. Bates SM, Rajasekhar A, Middeldorp S, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy. Blood Advances 2019;2:3317–3359.
3. Chan WS, Rey E, Kent NE, et al. Venous thromboembolism and antithrombotic therapy in pregnancy. J Obstet Gynaecol Can 2014;36:527–553.
4. Devis P, Knuttinen MG. Deep venous thrombosis in pregnancy: incidence, pathogenesis and endovascular management. Cardiovasc Diagn Ther 2017;7(Suppl 3):S309–S319.
5. Ormesher L, Simcox LE, Tower C, Greer IA. ‚To test or not to test‘, the arguments for and against thrombophilia testing in obstetrics. Obstet Med 2017;10:61–66.
6. Croles FN, Nasserinejad K, Duvekot JJ, et al. Pregnancy, thrombophilia, and the risk of first venous thrombosis: systematic review and bayesian meta‑analysis. Br Med J 2017;359:j4452.
7. Linnemann B, Bauersachs R, Rott H, et al. Diagnosis of pregnancy‑associated venous thromboembolism – position paper of the Working Group in Women’s Health of the Society of Thrombosis and Haemostasis (GTH). Vasa 2016;45:87–101.
zpět

