Ovlivnění kardiovaskulárního rizika perorálními antidiabetiky
III. interní klinika, 1. LF UK a VFN, Praha
Souhrn
Problematika kardiovaskulárních komplikací diabetu a jejich ovlivnění farmakologickou intervencí je v posledních letech velmi aktuální a počet intervenčních kardiovaskulárních studií v diabetologii narůstá geometrickou řadou. Článek shrnuje dostupné informace o kardiovaskulárních účincích dostupných antidiabetik s výjimkou inzulinu. Zabývá se jak starší antidiabetickou léčbou (metformin, deriváty sulfonylurey, glitazony), tak novějšími antidiabetiky (gliptiny, analoga GLP‑1, glifloziny), u kterých se zvláště zaměřuje na výsledky recentních kardiovaskulárních studií. (Kap Kardiol 2019; 11: 65–68)
Klíčová slova
· diabetes mellitus · glifloziny · gliptiny · analoga GLP‑1 · kardiovaskulární mortalita
Úvod
Diabetes mellitus je choroba s vysokou kardiovaskulární morbiditou i mortalitou. Více než polovina pacientů s diabetem umírá na infarkt myokardu či cévní mozkovou příhodu, tedy následek akcelerované aterosklerózy.1 Diabetes je tak v rozvoji aterosklerózy podobně významný rizikový faktor, jako je dyslipidemie, arteriální hypertenze či nikotinismus. Je nezpochybnitelné, že účinná hypolipidemická a antihypertenzní terapie, popř. postupy vedoucí k zanechání kouření, kardiovaskulární riziko významně snižují. Zásadní nárůst preskripce těchto lékových skupin pak v posledních dvaceti letech vede u nás i v zahraničí k poklesu kardiovaskulární mortality osob s diabetem.2 Vliv antidiabetické terapie na kardiovaskulární morbiditu a mortalitu je však z několika důvodů komplikovanější a každé antidiabetikum nelze považovat za kardiovaskulárně neutrální či dokonce kardioprotektivní.
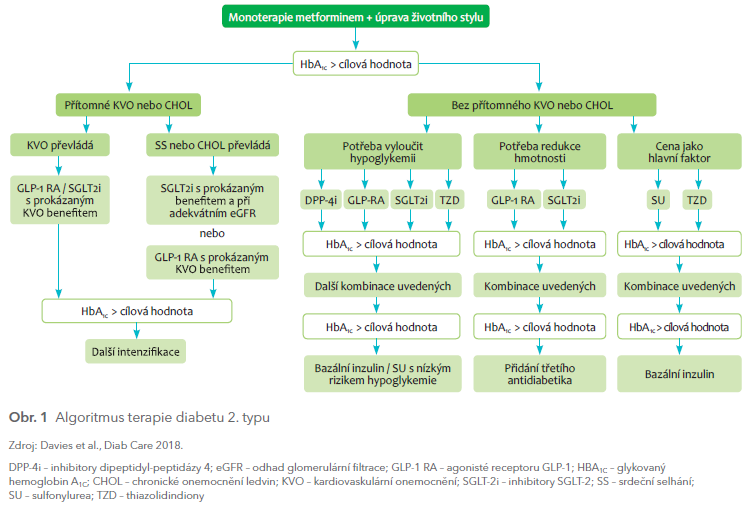
Hlavním požadavkem na účinné antidiabetikum vždy byl a zůstává jeho dobrý efekt na snižování glykemie, resp. v delším časovém horizontu snižování glykovaného hemoglobinu (HbA1c). Tento účinek také býval základním požadavkem pro úspěšnou registraci vyvíjených antidiabetik. Stačilo tak provádět kratší studie s mladší a kardiovaskulárně méně nemocnou subpopulací diabetiků. Naopak osoby s manifestním kardiovaskulárním onemocněním byly často ze studií vyloučeny, což vedlo k určité nekonzistenci kardiovaskulárních účinků. Dvě kontroverzní Nissenovy metaanalýzy pak dokonce ukázaly, že některá antidiabetika sama o sobě mohou kardiovaskulární mortalitu zvyšovat. Na jedné straně to byla v roce 2005 analýza muraglitazaru (duálního agonisty PPAR‑α a ‑γ), na straně druhé pak v roce 2007 metaanalýza zabývající se vlivem rosiglitazonu na kardiovaskulární mortalitu. Na základě těchto dat pak v roce 2008 americký Úřad pro kontrolu potravin a léčiv (FDA – Food and Drug Administration) začal u nově registrovaných antidiabetik vyžadovat klinické studie vyhodnocující kardiovaskulární úmrtí, infarkty myokardu, cévní mozkové příhody a hospitalizace pro srdeční selhání, tedy tzv. hlavní nežádoucí kardiovaskulární příhody (MACE – major adverse cardiovascular events). Problematika kardiovaskulárních komplikací se tak během posledních deseti let v diabetologii dostala výrazně do popředí. Úzký glukocentrický pohled na pacienta je nahrazován komplexnějším přístupem vyhodnocujícím individuální kardiovaskulární riziko každého pacienta, na jehož základě pak má být volena adekvátní antidiabetická terapie. Nová doporučení evropské a americké diabetologické společnosti (EASD a ADA) z roku 2018 pro léčbu diabetu 2. typu3 pak zdůrazňují právě tento přístup (obr. 1). Kardiovaskulární účinky jednotlivých antidiabetik jsou uvedeny v následujícím textu.
Metformin
Metformin je poměrně staré antidiabetikum, které se postupně stalo lékem první volby pro pacienty s diabetem 2. typu. Rovněž se stále více zdůrazňuje jeho přínos v léčbě pacientů s prediabetem (byť u nás zatím v režimu „off‑label“). Metformin snižuje glykemii několika mechanismy – potlačuje jaterní glukoneogenezi, zlepšuje využití glukózy ve svalech, ale také zlepšuje sekreci inzulinu beta buňkami a má celou řadu dalších, i neglykemických účinků. Hlavní výhodou je jeho bezpečnost, neboť při správné indikaci má minimum nežádoucích účinků, a navíc nezvyšuje riziko rozvoje hypoglykemie. Jeho kardiovaskulární přínos ukázala již v roce 1998 studie UKPDS, resp. analýza podskupiny zařazených pacientů s nadváhou / obezitou, kteří byli randomizováni do intenzifikované skupiny s metforminem (n = 342), nebo „léčeni“ konvenčními dietními opatřeními (n = 411). Pacienti léčení metforminem měli o 42 % snížené riziko úmrtí související s diabetem, o 36 % nižší mortalitu a o 39 % nižší riziko nefatálního infarktu myokardu (p = 0,01). Dlouhodobou prospěšnost léčby metforminem pak ukázala i analýza desetiletého sledování pacientů po ukončení studie UKPDS. Osoby původně ve studii léčené metforminem vykazovaly významně nižší rizika mikrovaskulárních i makrovaskulárních komplikací. Později proběhla jedna malá, „klasická“, placebem kontrolovaná studie s metforminem, kde jeho přidání k inzulinu vedlo ke snížení makrovaskulárních komplikací (HR 0,61; p = 0,02), byť jen v rámci sekundárního sledovaného ukazatele. Z pohledu dnešních velkých kardiovaskulárních studií se mohou zdát tyto analýzy relativně málo přesvědčivé. Naprostá většina velkých studií s metforminem totiž byla „jen“ observačních. Bylo by jistě vhodné mít velkou randomizovanou studii potvrzující kardioprotektivitu metforminu, avšak pravděpodobnost realizace takové studie s genericky dostupným metforminem je v dnešní době mizivá.
Deriváty sulfonylurey
Deriváty sulfonylurey jsou nejstaršími stále užívanými antidiabetiky a jejich preskripce má sice klesající trend, přesto však v celkovém objemu antidiabetik představují nezanedbatelnou část. Je to dáno nejen jejich dobrým účinkem na snižování glykemie, ale i jejich velmi nízkou cenou. Na druhou stranu však přinášejí riziko hypoglykemie, a navíc svým mechanismem účinku mohou zvyšovat apoptózu beta buněk. Kardiovaskulární účinky derivátů sulfonylurey nejsou jednoznačné. V minulosti používaný tolbutamid zvyšoval ve studii UGDP riziko kardiovaskulárního úmrtí, zatímco glibenclamid v pozdějších intervenčních studiích (ADVANCE, ACCORD) kardiovaskulární riziko nezvyšoval. V observačních studiích byly některé deriváty sulfonylurey (glimepirid, glibenclamid, glipizid) asociovány s vyšším kardiovaskulárním rizikem, zatímco gliclazid riziko nezvyšoval. V červnu tohoto roku byla prezentována intervenční studie CAROLINA porovnávající kardiovaskulární účinek glimepiridu a kardiovaskulárně neutrálního linagliptinu, ve které nebyl pozorován rozdíl kardiovaskulárních účinků mezi těmito přípravky.
Kardiovaskulární účinky derivátů sulfonylurey tedy jistě závisí na konkrétní účinné látce, a nelze je vidět paušálně negativně. Na druhou stranu je však nezbytné brát v potaz výrazně vyšší riziko hypoglykemií při terapii sulfonylureou oproti modernějším antidiabetickým přípravkům.
Glitazony
Glitazony (thiazolidindiony) účinně snižují glykemii, přitom mají jen minimální riziko rozvoje hypoglykemie. Jako jedny z mála antidiabetik snižují inzulinovou rezistenci, která je u mnoha pacientů s diabetem 2. typu značně zvýšena. Glitazony vedou k mírné redistribuci tekutin a zvyšování tělesné hmotnosti, a nejsou proto vhodné pro pacienty s kardiální insuficiencí. Kardiovaskulární účinky glitazonů se podobně jako u derivátů sulfonylurey liší dle konkrétního přípravku. Již zmiňovaná Nissenova metaanalýza prokazovala významně vyšší riziko rozvoje infarktu myokardu při terapii rosiglitazonem, a nakonec vedla k jeho stažení z evropského trhu a výraznému omezení v USA. Přitom následná, cíleně uspořádaná kardiovaskulární studie s rosiglitazonem (RECORD) sice prokázala vyšší riziko srdečního selhání, ale riziko infarktu myokardu významně zvýšeno nebylo (HR 1,14). Rozsáhlá studie PROactive s pioglitazonem sice neprokázala statisticky významné snížení primárního kardiovaskulárního ukazatele (celková mortalita, nefatální infarkt myokardu včetně němého, cévní mozková příhoda, amputace končetin, akutní koronární syndrom, srdeční intervence nebo revaskularizace dolních končetin), ale sekundární sledovaný parametr (celková mortalita, nefatální infarkt myokardu a cévní mozková příhoda) byl při terapii pioglitazonem snížen významně (HR 0,84; p = 0,027). V nedávné studii IRIS pioglitazon u osob bez diabetu a s inzulinovou rezistencí snížil riziko další cévní mozkové příhody, byť nesnížil celkovou mortalitu.
Pioglitazon tak v mezinárodních doporučeních zůstává jako možné antidiabetikum pro pacienty bez známého kardiovaskulárního onemocnění.
Gliptiny (inhibitory DPP‑4)
Gliptiny neboli inhibitory dipeptidyl‑peptidázy 4 (DPP‑4) prodlužují účinek fyziologicky postprandiálně uvolňovaných hormonů tenkého střeva (inkretinů) zablokováním jejich degradačního enzymu DPP‑4. Ke svému účinku vyžadují gliptiny zachovanou funkci beta buněk pankreatu, a proto jsou vhodné spíše v prvních letech trvání diabetu 2. typu. Vykazují jen minimální riziko rozvoje hypoglykemie. Ve srovnání se staršími antidiabetiky (např. deriváty sulfonylurey či glitazony) nevedou k vzestupu hmotnosti. Gliptiny byly na základě nařízení FDA první z antidiabetik cíleně testovaných v rozsáhlých mezinárodních studiích z hlediska kardiovaskulární bezpečnosti. V těchto studiích byla doložena s placebem srovnatelná bezpečnost stran úmrtí z kardiovaskulárních příčin, nefatálního infarktu myokardu a nefatální cévní mozkové příhody u čtyř gliptinů – saxagliptinu (studie SAVOR-TIMI 53), alogliptinu (studie EXAMINE), sitagliptinu (studie TECOS) a linagliptinu (studie CARMELINA). U prvních dvou účinných látek však byl v uvedených studiích pozorován vyšší počet hospitalizací pro srdeční selhání – nevýznamně u alogliptinu, výrazněji u saxagliptinu (o 27 %). Vildagliptin podobnou kardiovaskulární studii nemá.
Při volbě konkrétního přípravku z řad gliptinů by tedy na základě dostupných studií měly být preferovány sitagliptin či linagliptin.
Agonisté receptoru GLP‑1
Agonisté receptoru GLP‑1 působí podobně jako inkretiny a často se zařazují mezi perorální antidiabetika (lépe však neinzulinová antidiabetika), třebaže se zatím podávají injekčně do podkoží. Probíhají však studie se speciálně upravenými tabletami obsahujícími agonisty receptoru GLP‑1, a lze tak v blízké budoucnosti očekávat jejich perorální užívání. Agonisté receptoru GLP‑1 mají podobné účinky jako gliptiny, ale jejich efekt je delší a výraznější. Vykazují však vyšší výskyt nežádoucích účinků, převážně gastrointestinálních. Centrálním působením snižují chuť k jídlu, zpomalují vyprazdňování žaludku a v neposlední řadě omezují sekreci glukagonu alfa buňkami pankreatu, čímž mimo jiné snižují jaterní glukoneogenezi. Dle farmakokinetiky a farmakodynamiky se rozdělují na léky prandiální (exenatid podávaný dvakrát denně a lixisenatid podávaný jedenkrát denně) s dominantním účinkem na postprandiální glykemii, a dále na léky non‑prandiální (liraglutid podávaný jedenkrát denně, exenatid LAR, dulaglutid a semaglutid podávané jedenkrát týdně) s převážným vlivem na glykemii nalačno. Kardiovaskulárně neutrální efekt byl prokázán u lixisenatidu ve studii ELIXA. Zajímavější však byly výsledky studie LEADER s liraglutidem,4 které prokázaly snížení kombinovaného kardiovaskulárního rizika (úmrtí z kardiovaskulárních příčin, nefatálního infarktu myokardu či nefatální cévní mozkové příhody) o 13 %, resp. snížení kardiovaskulárního úmrtí o 22 % a pokles celkové mortality o 15 %. Navíc nebyl pozorován při léčbě liraglutidem ve srovnání s placebem častější výskyt pankreatitidy ani karcinomu pankreatu, tedy v minulosti opakovaně diskutovaných možných nežádoucích účinků inkretinové léčby. Podobně i kardiovaskulární studie se semaglutidem podávaným jednou týdně (SUSTAIN)5 prokázala snížení primárního sledovaného ukazatele (kardiovaskulární úmrtí, nefatální infarkt myokardu, nefatální cévní mozková příhoda) o 26 %. V letošním roce prezentovaná studie s dulaglutidem (REWIND)6 zahrnovala ze dvou třetin málo kardiovaskulárně rizikovou subpopulaci diabetiků, a přesto ukázala snížení primárního kardiovaskulárního ukazatele o 12 % (HR = 0,88; p = 0,026). Naopak kardiovaskulární studie s exenatidem LAR (EXSCEL) neprokázala jeho kardiovaskulární benefit.
Při léčbě diabetu agonisty receptoru GLP‑1 by tedy s vědomím aktuálně dostupných dat měl být preferován liraglutid, dulaglutid nebo semaglutid.
Glifloziny (inhibitory SGLT2)
Glifloziny představují nejnovější skupinu dostupných perorálních antidiabetik. Působí dominantně v ledvinách, kde inhibují zpětné vstřebávání glukózy z primární moči. Za fyziologických podmínek se glukóza hojně filtrovaná glomeruly do primární moči vrací zpět do krevní cirkulace díky aktivitě sodíko‑glukózového kotransportéru 1. a hlavně 2. typu (SGLT1 a SGLT2). Účinnost gliflozinů závisí na výši glykemie a také na kvalitě glomerulární filtrace. Glifloziny zablokováním zpětné reabsorpce mohou vést k vyloučení až 90 g glukózy denně, což má vliv nejen na snížení glykemie, ale také na snížení kalorické nálože (ztráta zhruba 400 kcal denně). Navozená osmotická diuréza pak přispívá k mírnému poklesu krevního tlaku. Výsledkem těchto vlivů je navíc pokles tělesné hmotnosti. Glifloziny snižují glykemii, avšak nemají přímý vliv na sekreci inzulinu, a tudíž primárně nevyvolávají hypoglykemii.
U nás jsou dostupné tři přípravky – dapagliflozin, canagliflozin a empagliflozin – a všechny mají dokončené rozsáhlé kardiovaskulární studie. Studie s empagliflozinem (EMPA‑REG OUTCOME) ve sledované populaci kardiovaskulárně velmi rizikových pacientů s diabetem 2. typu jako první prokázala významné snížení kombinovaného kardiovaskulárního parametru (úmrtí z kardiovaskulárních příčin, nefatální infarkt myokardu a nefatální cévní mozková příhoda) o 14 %. Oproti placebu pak empagliflozin snížil riziko úmrtí z KV příčin o 38 % a riziko hospitalizace pro srdeční selhání o 35 %.7 Studie s canagliflozinem (CANVAS Program)8 prokázala rovněž významné snížení kombinovaného kardiovaskulárního ukazatele (HR = 0,82), avšak nebylo pozorováno významné snížení kardiovaskulární mortality. Studie však zároveň poukázala na skoro dvojnásobné riziko amputací dolních končetin. Toto riziko se již nepotvrdilo v letos prezentované studii CREDENCE, ve které již však nebyly zařazeny osoby s anamnézou defektu na dolních končetinách či jeho zvýšeného rizika. Studie s dapagliflozinem (DECLARE‑TIMI 58)9 neprokázala významné snížení kombinovaného kardiovaskulárního ukazatele, avšak je třeba zmínit, že do studie byla zařazena výrazně kardiovaskulárně zdravější populace ve srovnání se studií CANVAS, a obzvláště se studií EMPA‑REG.
Všechny uvedené glifloziny srovnatelně snižují riziko hospitalizace pro srdeční selhání a byl u nich pozorován výrazný nefroprotektivní účinek. Z hlediska kardioprotektivity má nejsilnější data empagliflozin.
Glinidy a akarbóza
Význam glinidů (nesulfonylureových sekretagog) je pro malý účinek a zanedbatelnou preskripci marginální, navíc nejsou dostupné relevantní kardiovaskulární studie s těmito přípravky.
Akarbóza (inhibitor α‑glukosidázy) zamezující štěpení polysacharidů ve střevě patří rovněž mezi okrajová antidiabetika. V intervenční studii ACE akarbóza nezlepšila kardiovaskulární ukazatele u rizikové populace s porušenou glukózovou tolerancí a kardiovaskulárním onemocněním, avšak snížila riziko rozvoje diabetu o 18 %.
Závěr
Kardiovaskulární morbidita pacientů s diabetem se sice postupně snižuje, přesto však zůstává velmi významnou komplikací diabetu. Kardiovaskulární studie s novějšími antidiabetiky přinášejí nejen potvrzení kardiovaskulární bezpečnosti současné léčby, ale v některých případech přinášejí důkazy o kardioprotektivních účincích. A právě takové výsledky by nás měly motivovat k uvážlivému výběru a preferenci těch antidiabetik, která nejen účinně snižují glykemii, ale ještě snižují mortalitu našich pacientů.
Podpořeno MZ ČR – RVO VFN64165.
Literatura
1. Einarson TR, et al. Prevalence of cardiovascular disease in type 2 diabetes: a systematic literature review of scientific evidence from across the world in 2007–2017. Cardiovasc Diabetol 2018;17:83
2. Škrha J, jr, Škrha J. Kardiovaskulární mortalita u diabetu. Vnitř Lék 2017;63:447–449.
3. Davies MJ, et al. Management of hyperglycemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diab Care 2018;41:2669–2701.
4. Marso SP, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016;375:311–322.
5. Marso SP, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016;375:1834–1844.
6. Gerstein HC, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double‑blind, randomised placebo‑controlled trial. Lancet 2019;394:121–130.
7. Zinman B, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117–2128.
8. Neal B, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Eng J Med 2017;377:644–657.
9. Wiviott SD, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347–357.
zpět

