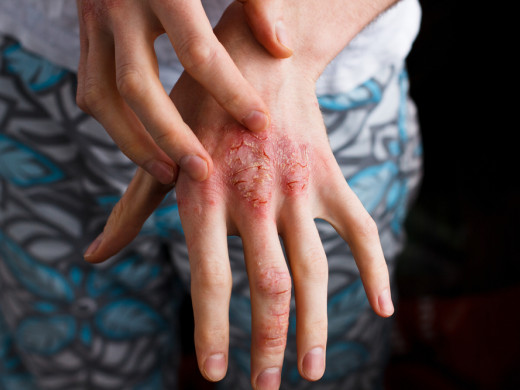
Role kožního mikrobiomu v patogenezi atopické dermatitidy
Atopická dermatitida (AD) je chronické silně svědivé zánětlivé onemocnění kůže, které postihuje 5,5 % dospělé populace v Evropě. U AD je kožní bariéra narušena na více úrovních. V patofyziologii AD se uplatňují faktory genetické (např. mutace…